
Médicament vétérinaire sous ordonnance
disponible uniquement
chez un pharmacien (officine) ou chez un vétérinaire (après consultation) |
1. Dénomination du médicament vétérinaire
AMOXIBACTIN 50 MG COMPRIMES POUR CHIENS ET CHATS
2. Composition qualitative et quantitative
Un comprimé contient : | | | | Substance(s) active(s) : | | Amoxicilline ………………………………….… | 50 mg | (sous forme de trihydrate) | | (soit 57,50 mg de trihydrate d’amoxicilline) | |
Pour la liste complète des excipients, voir rubrique « Liste des excipients ».
3. Forme pharmaceutique
Comprimé.
Comprimé blanc à blanc cassé tacheté de brun, rond et convexe, aromatisé, avec une barre de sécabilité en croix sur une face.
Les comprimés peuvent être divisés en deux ou quatre parties égales.
4. Informations cliniques
4.1. Espèces cibles
4.2. Indications d'utilisation, en spécifiant les espèces cibles
Chez les chiens et les chats :
- Traitement des infections primaires et secondaires des voies respiratoires, telles que la rhinite due à Pasteurella spp. et Streptococcus spp., et la bronchopneumonie due à Pasteurella spp., Escherichia coli et aux cocci à Gram positif.
- Traitement des infections primaires des voies urogénitales, telles que la pyélonéphrite et les infections urinaires basses dues à Escherichia coli, Proteus spp. et aux cocci à Gram positif, l'endométrite due à Escherichia coli, Streptococcus canis et Proteus spp., et la vaginite consécutive à des infections mixtes.
- Traitement des infections des glandes mammaires dues aux cocci à Gram positif et à Escherichia coli.
- Traitement des infections cutanées localisées dues à Streptococcus spp.
4.3. Contre-indications
Ne pas utiliser en cas d'hypersensibilité aux pénicillines ou à d'autres substances de la famille des ß-lactamines ou à l'un des excipients.
Ne pas administrer aux gerbilles, cobayes, hamsters, lapins et chinchillas.
Ne pas utiliser chez les animaux présentant un dysfonctionnement rénal grave accompagné d'anurie ou d'oligurie.
4.4. Mises en garde particulières à chaque espèce cible
4.5. Précautions particulières d'emploi
i) Précautions particulières d'emploi chez l'animal
Chez les animaux présentant un dysfonctionnement hépatique et rénal, le schéma posologique doit être soigneusement évalué et l'utilisation du produit doit reposer sur une évaluation du rapport bénéfice/risque par le vétérinaire.
Une prudence particulière est conseillée en cas d'utilisation chez de petits herbivores autres que ceux mentionnés dans la rubrique « Contre-indications ».
En raison de la probable variabilité (temporelle et géographique) de survenue des résistances bactériennes à l'amoxicilline, un échantillonnage bactériologique et un test de sensibilité sont recommandés.
Dans la mesure du possible, le produit devra être utilisé uniquement sur la base d'un test de sensibilité.
L'utilisation du produit en dehors des recommandations du RCP peut augmenter la prévalence des bactéries résistantes à l'amoxicilline et diminuer l'efficacité du traitement par d'autres antibiotiques de la famille des bêta-lactamines ou par d'autres classes d'antibiotiques en raison du risque de résistance croisée.
Les politiques officielles, nationales et régionales, en matière d'utilisation des antibiotiques doivent être prises en compte lorsque le produit est utilisé.
ii) Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Les pénicillines et les céphalosporines peuvent provoquer une hypersensibilité (allergie) après injection, inhalation, ingestion ou contact cutané. L'hypersensibilité aux pénicillines peut entraîner des réactions croisées aux céphalosporines et inversement. Les réactions allergiques à ces substances peuvent occasionnellement être graves.
Ne manipulez pas ce produit si vous savez y être sensibilisé(e) ou s'il vous a été conseillé de ne pas travailler avec ce type de préparations.
Manipulez ce produit avec un soin extrême afin d'éviter toute exposition, en prenant toutes les précautions recommandées.
Si vous développez des symptômes après exposition, tels qu'une éruption cutanée, consultez un médecin et montrez-lui cette mise en garde. Le gonflement du visage, des lèvres ou des yeux ou les difficultés à respirer constituent des symptômes plus graves et nécessitent une prise en charge médicale urgente.
Lavez-vous les mains après avoir manipulé les comprimés.
iii) Autres précautions
4.6. Effets indésirables (fréquence et gravité)
Des symptômes gastro-intestinaux légers (diarrhée et vomissements) peuvent se produire après l'administration du produit. Des réactions d'hypersensibilité (réactions allergiques cutanées, anaphylaxie) peuvent survenir occasionnellement. Dans ce cas, l'administration doit être interrompue et un traitement symptomatique doit être administré.
4.7. Utilisation en cas de gravidité, de lactation ou de ponte
A ce jour, les études menées sur les animaux de laboratoire n'ont pas mis en évidence d'effets tératogènes, foetotoxiques ou maternotoxiques. Cependant, étant donné qu'aucune étude n'a été réalisée chez les chiennes et les chattes pendant la gestation ou la lactation, il est recommandé de n'utiliser le produit qu'après évaluation du rapport bénéfice/risque établi par le vétérinaire.
4.8. Interactions médicamenteuses et autres formes d'interactions
Le chloramphénicol, les macrolides, les sulfamides et les tétracyclines peuvent inhiber l'effet antibactérien des pénicillines en raison de l'apparition rapide de leur action bactériostatique. Le risque de réaction allergique croisée avec d'autres pénicillines doit être pris en compte.
Les pénicillines peuvent amplifier les effets des aminosides.
4.9. Posologie et voie d'administration
Administration par voie orale chez le chien et le chat.
Afin de s'assurer que la posologie est correcte et d'éviter tout sous-dosage, le poids de l'animal doit être déterminé aussi précisément que possible.
Posologie
La dose recommandée est de 10 mg d'amoxicilline par kg de poids corporel, deux fois par jour pendant un minimum de 5 jours consécutifs. Dans la majorité des cas courants, l'infection répond à un traitement de 5 à 7 jours. Si aucune amélioration n'est observée après 5 à 7 jours, le diagnostic doit être réévalué. En cas d'infection chronique ou réfractaire, un traitement plus long peut être nécessaire. Le tableau ci-dessous indique les quantités de produit à administrer à la dose standard de 10 mg par kg de poids corporel deux fois par jour. 
Les comprimés peuvent être divisés en deux ou quatre parties égales pour s'assurer d'une posologie exacte. Placez le comprimé sur une surface plate, avec la face portant la barre de sécabilité tournée vers le haut et la face convexe (arrondie) tournée vers le plan de travail.
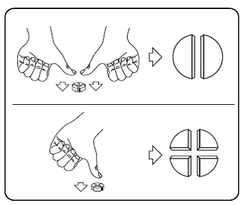
Deux demi-comprimés : appuyez avec vos pouces des deux côtés du comprimé.
Quatre quarts de comprimé : appuyez avec votre pouce au centre du comprimé.
4.10. Surdosage (symptômes, conduite d'urgence, antidotes), si nécessaire
En cas surdosage, aucun effet indésirable autre que ceux décrits dans la rubrique « Effets indésirables (fréquence et gravité) » n'a été identifié.
4.11. Temps d'attente
5. Propriétés pharmacologiques
Groupe pharmacothérapeutique : antibactériens à usage systémique, pénicillines à large spectre.
Code ATC-vet : QJ01CA04.
5.1. Propriétés pharmacodynamiques
Propriétés générales
L'amoxicilline est un antibiotique de la famille des bêta-lactamines et sa structure comprend le cycle bêta-lactame et le cycle thiazolidine communs à toutes les pénicillines. Les antibiotiques de la famille des bêta-lactamines empêchent la formation de la paroi cellulaire bactérienne en interférant avec la phase finale de la synthèse du peptidoglycane. Ils inhibent l'activité des enzymes transpeptidases, qui catalysent la réticulation des polymères de glycopeptides formant la paroi cellulaire. Ils exercent une action bactéricide mais provoquent uniquement la lyse des cellules en cours de croissance. Les antibiotiques de la famille des bêta-lactamines peuvent être désignés sous l'appellation d'antibiotiques temps-dépendants.
Spectre antibiotique
L'amoxicilline est un antibiotique à large spectre, généralement actif contre certaines bactéries à Gram négatif et contre la plupart des bactéries à Gram positif (Germ-vet 2007), par exemple les germes sensibles à la pénicilline de type Pasteurella spp., Proteus spp., Streptococcus spp., E. coli et cocci à Gram positif.
Résistance
L'amoxicilline est acido-résistante mais n'est pas résistante à l'action des bêta-lactamases, qui peuvent hydrolyser les molécules, entraînant l'ouverture de la structure du cycle bêta-lactame et l'inactivation de l'antibiotique.
La plupart des bactéries à Gram négatif présentent une résistance intrinsèque à de nombreuses bêta-lactamines. Cela est dû en partie au mécanisme d'action du médicament et à la structure de la membrane bactérienne.
La résistance acquise aux bêta-lactamines au sein des isolats cliniques peut être due à l'activité des bêta-lactamases induite par les plasmides ou à des mutations affectant les locus chromosomiques. Dans certaines souches, une mutation unique peut être responsable d'une résistance tandis que, dans d'autres souches, la résistance peut être due à plusieurs mutations.
La prévalence de la résistance acquise peut être élevée avec E. coli.
5.2. Caractéristiques pharmacocinétiques
L'amoxicilline est bien absorbée après administration orale. Chez le chien, la biodisponibilité systémique est de 60-70 %. L'amoxicilline présente un volume de distribution apparent relativement faible, un faible taux de liaison avec les protéines plasmatiques (34 % chez le chien) et une demi-vie d'élimination brève en raison de l'excrétion tubulaire active par les reins.
Après absorption, les concentrations les plus élevées sont constatées dans les reins (urine) et la bile, suivis du foie, des poumons, du coeur et de la rate.
La diffusion de l'amoxicilline dans le liquide céphalo-rachidien est faible, sauf en cas d'inflammation des méninges.
6. Informations pharmaceutiques
6.1. Liste des excipients
Stéarate de magnésium
Cellulose microcristalline
Silice colloïdale anhydre
Carboxyméthylamidon sodique
Lactose monohydraté
Levure (déshydratée)
Arôme poulet
6.2. Incompatibilités
6.3. Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 3 ans.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 30°C.
Toute fraction de comprimé non utilisée doit être replacée dans la plaquette ouverte et utilisée dans les 4 jours.
6.5. Nature et composition du conditionnement primaire
Plaquette thermoformée polychlorure de vinyle / polyéthylène / chlorure de polyvinylidene - aluminium
6.6. Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Les conditionnements vides et tout reliquat de produit doivent être éliminés suivant les pratiques en vigueur régies par la réglementation sur les déchets.
7. Titulaire de l'autorisation de mise sur le marché
LE VET
WILGENWEG 7
3421 TV OUDEWATER
PAYS-BAS
8. Numéro(s) d'autorisation de mise sur le marché
FR/V/0250604 9/2014
Boîte de 1 plaquette thermoformée de 10 comprimés sécables
Boîte de 2 plaquettes thermoformées de 10 comprimés sécables
Boîte de 3 plaquettes thermoformées de 10 comprimés sécables
Boîte de 4 plaquettes thermoformées de 10 comprimés sécables
Boîte de 6 plaquettes thermoformées de 10 comprimés sécables
Boîte de 7 plaquettes thermoformées de 10 comprimés sécables
Boîte de 8 plaquettes thermoformées de 10 comprimés sécables
Boîte de 9 plaquettes thermoformées de 10 comprimés sécables
Boîte de 10 plaquettes thermoformées de 10 comprimés sécables
Boîte de 25 plaquettes thermoformées de 10 comprimés sécables
Boîte de 50 plaquettes thermoformées de 10 comprimés sécables
Boîte de 5 plaquettes thermoformées de 10 comprimés sécables
Toutes les présentations peuvent ne pas être commercialisées.
9. Date de première autorisation/renouvellement de l'autorisation
10. Date de mise à jour du texte
|
|

