|
1. Dénomination du médicament vétérinaire
EPITYL 60 MG COMPRIMES POUR CHIENS
2. Composition qualitative et quantitative
Un comprimé contient : | | | | Substance(s) active(s) : | | Phénobarbital …………………………….. | 60 mg |
Pour la liste complète des excipients, voir rubrique « Liste des excipients ».
3. Forme pharmaceutique
Comprimé. Comprimés ronds blancs avec barre de sécabilité en croix sur une face. Les comprimés peuvent être divisés en deux ou en quatre parties égales.
4. Informations cliniques
4.1. Espèces cibles
4.2. Indications d'utilisation, en spécifiant les espèces cibles
Le phénobarbital est un agent antiépileptique pour la prévention des crises dues à l'épilepsie généralisée chez les chiens.
4.3. Contre-indications
Ne pas utiliser en cas d'hypersensibilité aux barbituriques. Ne pas utiliser chez les animaux présentant une insuffisance hépatique grave. Ne pas utiliser chez les animaux atteints de troubles rénaux ou cardiovasculaires graves. Ne pas utiliser chez les chiens pesant moins de 6 kg.
4.4. Mises en garde particulières à chaque espèce cible
La décision d’initier un traitement antiépileptique avec du phénobarbital doit être évaluée pour chaque cas individuel et dépend du nombre, de la fréquence, de la durée , ainsi que de la sévérité des crises convulsives du chien. L’administration des comprimés doit avoir lieu chaque jour à la (aux) même (s) heure(s) et être coordonnée avec l’heure des repas de manière cohérente. L’arrêt du traitement ou la transition vers d’autres types de traitements antiépileptiques doit être réalisé progressivement afin d’éviter de provoquer une augmentation de la fréquence des crises convulsives.
4.5. Précautions particulières d'emploi
i) Précautions particulières d'emploi chez l'animal
La prudence est recommandée chez les animaux présentant une insuffisance des fonctions hépatique ou rénale, une hypovolémie, une anémie et une insuffisance cardiaque ou respiratoire. Le risque d'effets hépatotoxiques secondaires peut être diminué ou retardé en utilisant une dose efficace la plus faible possible. Une surveillance des paramètres hépatiques est recommandée en cas de traitement prolongé. Il est recommandé d'évaluer le statut clinique de l’animal 2 à 3 semaines après le début du traitement puis tous les 4 à 6 mois (exemple : dosage des enzymes hépatiques et des acides biliaires dans le sérum). Il est important de garder à l’esprit que l'hypoxie, entre autres peut entraîner une augmentation des taux d'enzymes hépatiques après une convulsion. Le phénobarbital peut augmenter l'activité de la phosphatase alcaline sérique et des transaminases. Ces taux peuvent témoigner de changements non pathologiques, mais pourraient aussi représenter les effets d’une hépatotoxicité; des tests de la fonction hépatique sont recommandés. L’augmentation des taux des enzymes hépatiques ne nécessite pas toujours une réduction de la dose de phénobarbital si le taux d’acides biliaires sériques reste dans l’intervalle physiologique. Chez les chiens épileptiques stabilisés, il est recommandé de ne pas remplacer les comprimés EPITYL 60 MG par d'autres formulations contenant du phénobarbital. Toutefois, si cela ne peut pas être évité, des précautions supplémentaires doivent être prises. Cela inclut des contrôles plus fréquents des concentrations plasmatiques de phénobarbital afin de garantir que les concentrations thérapeutiques sont maintenues. Une surveillance de l’augmentation des effets secondaires et des dysfonctionnements hépatiques doit être effectuée plus régulièrement jusqu'à ce que la stabilisation soit confirmée. L’arrêt d’un traitement par des formulations de phénobarbital doit être réalisé progressivement pour éviter de provoquer une augmentation de la fréquence des convulsions.
ii) Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Les personnes présentant une hypersensibilité connue aux barbituriques devraient éviter tout contact avec le médicament vétérinaire. Se laver soigneusement les mains après utilisation. Prendre toutes les précautions nécessaires pour éviter tout contact des enfants avec le produit. Les enfants sont particulièrement exposés au risque d'intoxication qui peut s'avérer fatal. En cas d'ingestion accidentelle, consulter immédiatement un médecin et lui montrer la notice ou l'étiquette. Si possible, le médecin doit être informé du temps écoulé depuis l’incident et de la quantité de comprimés ingérés, car ces informations peuvent lui permettre d’adapter au mieux le traitement à mettre en place. Chaque fois qu'un morceau de comprimé non utilisé est conservé jusqu'à la prochaine utilisation, il doit être replacé soit dans la plaquette ouverte et réinséré dans la boîte en carton soit replacé dans l’emballage et conservé dans un endroit sûr hors de la portée et de la vue des enfants car il représente un risque pour la santé des jeunes enfants en cas d'ingestion accidentelle.
iii) Autres précautions
4.6. Effets indésirables (fréquence et gravité)
Au début du traitement, une ataxie et une sédation peuvent se produire, mais ces effets sont habituellement transitoires et disparaissent chez la plupart des chiens (mais pas tous) au cours du traitement. Certains animaux peuvent présenter une hyperexcitabilité paradoxale, en particulier au tout début du premier traitement. Comme cette hyperexcitabilité n’est pas liée à un surdosage, aucune diminution de la dose n’est nécessaire. Une polyurie, une polydipsie et une polyphagie peuvent se produire à des concentrations plasmatiques de substance active moyennes ou élevées; ces effets peuvent être réduits en limitant la consommation de nourriture. La sédation et l’ataxie deviennent souvent des préoccupations importantes lorsque les concentrations plasmatiques de substance active atteignent les valeurs limites supérieures de l'intervalle thérapeutique. De fortes concentrations plasmatiques de principe actif peuvent conduire à une hépatotoxicité. Le phénobarbital peut avoir des effets délétères sur les cellules souches de la moelle osseuse. Les conséquences en sont une pancytopénie et / ou une neutropénie immunotoxique. Ces réactions disparaissent après l’arrêt du traitement. Le traitement des chiens par le phénobarbital peut entraîner une diminution des taux sériques de thyroxine totale (TT4) ou de thyroxine libre (FT4), sans que ceci n’indique nécessairement une hypothyroïdie. Un traitement substitutif avec des hormones thyroïdiennes ne devra être instauré que si des signes cliniques de la maladie sont constatés. En cas d‘effets secondaires sévères, il est recommandé de diminuer la dose.
4.7. Utilisation en cas de gestation, de lactation ou de ponte
Le phénobarbital traverse la barrière placentaire et, à de fortes doses, des symptômes de sevrage (réversibles), chez les nouveau-nés ne peuvent être exclus. Les études menées chez les animaux de laboratoire ont mis en évidence un effet du phénobarbital sur la croissance prénatale, en particulier sur le développement sexuel. Une prédisposition aux saignements chez le nouveau-né a été associée au traitement par le phénobarbital pendant la gestation. L’administration de vitamine K à la femelle pendant les 10 jours précédant la mise-bas peut aider à diminuer ces effets sur le fœtus. L’innocuité de ce produit n’a pas été établie chez les chiennes gestantes. Le bénéfice du traitement doit être plus important que le risque potentiel associé aux crises convulsives épileptiques sur le fœtus (hypoxie et acidose). En conséquence, en cas de gestation, l’arrêt du traitement antiépileptique n’est pas recommandé ; cependant, la dose devrait être la plus faible possible. Le phénobarbital est excrété en faible quantité dans le lait maternel et durant l’allaitement, les chiots doivent être surveillés avec attention pour éviter les effets sédatifs indésirables. Le sevrage précoce peut être une option. Si de la somnolence ou des effets sédatifs (qui pourraient interférer avec la tétée) apparaissent chez les nouveau-nés allaités, un allaitement artificiel devrait être choisi. L’utilisation du médicament chez les chiennes durant la gestation et la lactation ne devra se faire qu’après évaluation du rapport bénéfices/risques par le vétérinaire.
4.8. Interactions médicamenteuses et autres formes d'interactions
Une dose thérapeutique de phénobarbital pour traitement antiépileptique peut induire de manière significative des protéines plasmatiques, (telles que la α-1 glycoprotéine acide, GPA), qui se lient aux médicaments. Le phénobarbital peut réduire l'activité de certains médicaments en augmentant leur métabolisme par l’induction d'enzymes impliquées dans le métabolisme des médicaments dans les microsomes hépatiques. Par conséquent, une attention particulière doit être accordée aux caractéristiques pharmacocinétiques et aux doses de médicaments administrés simultanément. La concentration plasmatique de certains médicaments est diminuée dans le cas d'administration concomitante de phénobarbital (exemples : la ciclosporine, les hormones thyroïdiennes, et la théophylline). L'utilisation concomitante d'autres médicaments ayant une action dépressive centrale (comme les analgésiques narcotiques, les dérivés morphiniques, les phénothiazines, les antihistaminiques, la clomipramine et le chloramphénicol) peut augmenter l'effet du phénobarbital. La cimétidine et le kétoconazole sont des inhibiteurs des enzymes hépatiques ; l'utilisation concomitante avec le phénobarbital peut induire une augmentation de la concentration plasmatique de phénobarbital. Le phénobarbital peut diminuer l'absorption de la griséofulvine. L'utilisation concomitante avec du bromure de potassium augmente le risque de pancréatite. L'utilisation simultanée de comprimés de phénobarbital et de primidone est déconseillée, car la primidone est principalement métabolisée en phénobarbital. Les médicaments suivants peuvent abaisser le seuil épileptogène : quinolones, doses élevées d’antibiotiques de la famille des ß-lactamines, théophylline, aminophylline, ciclosporine et propofol par exemple. Ces médicaments ne doivent être utilisés qu’en cas d’absolue nécessité et lorsqu’il n’existe aucune alternative plus sûre.
4.9. Posologie et voie d'administration
Administration par voie orale. La posologie requise variera dans une certaine mesure en fonction des animaux, de la nature et de la sévérité des troubles. Le médicament doit être administré au chien par voie orale, en commençant par une dose de 2 à 5 mg de phénobarbital par kg de poids corporel par jour. La dose doit être divisée et administrée en deux prises par jour. Les concentrations plasmatiques à l'état d'équilibre ne sont pas atteintes avant 1 à 2 semaines après le début du traitement. L’effet du traitement n’est donc pas visible avant deux semaines et les doses ne doivent pas être augmentées au cours de cette période. Les comprimés doivent être administrés tous les jours aux mêmes heures pour optimiser la réussite du traitement. Si les convulsions ne sont pas contrôlées, la posologie peut être augmentée par paliers de 20 %, en associant des mesures de surveillance des concentrations plasmatiques de phénobarbital. La concentration plasmatique de phénobarbital peut être vérifiée lorsque l'état d'équilibre a été atteint, et si elle est inférieure à 15 µg/ml, la dose peut être ajustée en conséquence. Si les crises se reproduisent, la dose peut être augmentée jusqu'à une concentration plasmatique maximale de 45 μg/ml. De fortes concentrations plasmatiques peuvent être associées à une hépatotoxicité. Des échantillons de sang pourront être prélevés en même temps pour permettre de déterminer la concentration plasmatique de phénobarbital, de préférence lorsque celle-ci est minimale, peu de temps avant l’administration de la dose de phénobarbital suivante prévue. Les concentrations plasmatiques doivent être interprétées en fonction de la réponse au traitement observée et d’une évaluation clinique complète, comprenant le suivi des symptômes d'effets toxiques chez chaque animal. Les données cliniques suggèrent que des variations considérables peuvent être observées dans les concentrations plasmatiques de phénobarbital chez certains animaux. Cette variation peut aller chez un animal jusqu’à une concentration plasmatique minimale de phénobarbital inférieure au niveau minimum thérapeutique classique (15 µg/ml) et une concentration plasmatique maximale approchant le niveau maximum (45 µg/ml). Si le contrôle des crises est insuffisant chez ces animaux, des précautions doivent être prises lors de l'augmentation de la dose que les niveaux toxiques ne soient pas atteints ou dépassés. Il peut être nécessaire chez ces animaux de mesurer les concentrations plasmatique de phénobarbital maximales et minimales (les concentrations plasmatiques maximales sont atteintes environ 3 heures après l'administration). Si les convulsions ne sont pas contrôlées de manière satisfaisante et si la concentration plasmatique maximale de phénobarbital est d'environ 40 µg/ml, alors le diagnostic doit être revu et / ou un deuxième produit antiépileptique (tels que le bromure) doit être ajouté au protocole de traitement. Les comprimés peuvent être divisés en deux ou en quatre parties égales de manière à assurer un dosage précis. Pour casser un comprimé en quatre, placez le sur une surface plane avec le côté marqué au-dessus et appliquez une pression avec le pouce sur le milieu du comprimé. 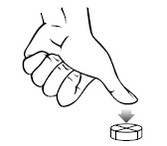 Pour casser un comprimé en deux, placez le sur une surface plane avec le côté marqué au-dessus, maintenez la moitié du comprimé et appuyez sur l’autre moitié. 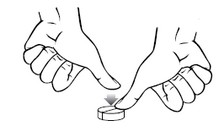
4.10. Surdosage (symptômes, conduite d'urgence, antidotes), si nécessaire
Les symptômes du surdosage sont : - dépression du système nerveux central qui se manifeste par les signes allant du sommeil au coma, - problèmes respiratoires, - problèmes cardiovasculaires, hypotension et choc conduisant à l'insuffisance rénale et à la mort. En cas de surdosage, éliminer le produit ingéré de l’estomac et apporter une assistance respiratoire et cardiovasculaire si nécessaire. Il n'y a pas d'antidote spécifique, mais des stimulants du système nerveux central, (comme le Doxapram) peuvent stimuler le centre respiratoire.
4.11. Temps d'attente
5. Propriétés pharmacologiques
Groupe pharmacothérapeutique : antiépileptiques/barbituriques et dérivés. Code ATC-vet : QN03AA02.
5.1. Propriétés pharmacodynamiques
Les effets antiépileptiques du phénobarbital résultent probablement d’au moins deux mécanismes : une réduction de la transmission monosynaptique, induisant sans doute une diminution de l’excitabilité neuronale et une augmentation du seuil de stimulation électrique de l’aire motrice corticale.
5.2. Caractéristiques pharmacocinétiques
Après administration orale de phénobarbital aux chiens, celui-ci est rapidement absorbé et les concentrations plasmatiques maximales sont atteintes dans les 3 heures. La biodisponibilité est comprise entre 86 % et 96 %. Une fois dans le sang, 45 % sont liés aux protéines plasmatiques. Le métabolisme se fait par hydroxylation aromatique du groupe phényl en position para et environ un tiers du médicament est excrété dans les urines sous forme inchangée. La demi-vie d’élimination varie considérablement selon les individus et est comprise entre 40 et 90 heures. Une fois le traitement initié, les concentrations plasmatiques à l’état d’équilibre ne sont pas atteintes avant 1 à 2 semaines. Après administration orale du produit à 16 Beagles, 2 fois par jour à 12 heures d’intervalle, pendant 14 jours et à la dose d’un demi-comprimé par chien, ce qui équivaut à 4 - 5 mg par kg de poids corporel, les concentrations plasmatiques maximales ont été atteintes dans les 3 heures, elles variaient de 32,30 à 47,64 µg/ml et les concentrations plasmatiques minimales variaient de 12,94 à 21,05 µg/ml.
6. Informations pharmaceutiques
6.1. Liste des excipients
Lactose monohydraté Cellulose microcristalline Stéarate de magnésium Amidon de maïs Talc Arome viande grillée
6.2. Incompatibilités majeures
6.3. Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente: 3 ans. Durée de conservation des fractions de comprimé : 2 jours.
6.4. Précautions particulières de conservation
Pas de précautions particulières de conservation. Les fractions de comprimé doivent être conservées dans l’emballage d’origine. Toute fraction de comprimé doit être éliminée après deux jours de conservation. Conserver la plaquette thermoformée dans l’emballage d’origine.
6.5. Nature et composition du conditionnement primaire
Flacon polyéthylène haute densité
Bouchon à vis polypropylène avec sécurité enfant
Plaquette thermoformée PVC - aluminium
6.6. Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Les conditionnements vides et tout reliquat de produit doivent être éliminés suivant les pratiques en vigueur régies par la réglementation sur les déchets.
7. Titulaire de l'autorisation de mise sur le marché
CHANELLE PHARMACEUTICALS MANUFACTURING
DUBLIN ROAD
CO. GALWAY
- LOUGHREA
IRLANDE
8. Numéro(s) d'autorisation de mise sur le marché
FR/V/4308466 5/2015
Boîte de 1 plaquette thermoformée de 10 comprimés quadrisécables
Boîte de 2 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 3 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 4 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 5 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 6 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 7 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 8 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 9 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 10 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 50 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 100 plaquettes thermoformées de 10 comprimés quadrisécables
Flacon de 100 comprimés quadrisécables
Flacon de 500 comprimés quadrisécables
Toutes les présentations peuvent ne pas être commercialisées.
9. Date de première autorisation/renouvellement de l'autorisation
10. Date de mise à jour du texte
| 
